- 活動與消息
活動與消息
2018/03/09
益安醫材獲FDA上市許可
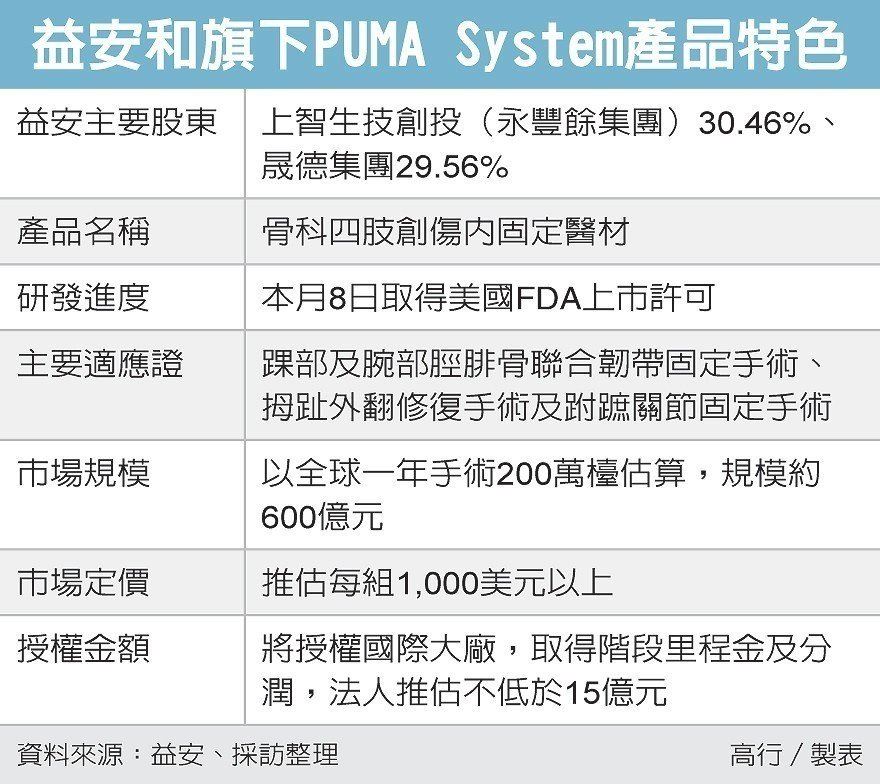
國內醫材廠醫益安生醫昨(8)日宣布喜訊,旗下高階骨材植入物取得美國食品藥物管理局(FDA)上市許可,將加速國際授權進度,金額至少15億元起跳,未來產品線將以一年一產品授權的速度,帶領台灣醫材征服全球一年600億元的市場。
益安董事長張有德對未來國際授權深具信心,指美國關節創傷每年手術約百萬檯,全球約200萬檯,該創新骨材對傳統骨釘和線材具備很強的替代性,正是其優勢和價值所在。
國內醫喜訊連連,繼中裕愛滋病新藥「TMB-355」取得美國FDA藥證,開啟台灣新藥先河後,台灣高階醫材接力報喜,主攻微創高階醫材的益安昨日宣布,其轉投資公司Panther Orthopedics研發的骨科四肢創傷內固定醫材(PUMA System),取得美國FDA 510(k)產品上市許可,為台灣生技進軍全球再下一城。
這是益安今年開春來二度報喜,本月2日將旗下產品首度成功授權國際大廠,股價已連四日亮燈漲停,昨日收在124元,創下去年1月來最高價,益安主要大股東包括永豐餘旗下的上智生技創投及晟德集團,持股比分別為30.46%及29.56%,可說是大贏家。
據了解,「PUMA System」屬動態內固定功能之骨科植入醫材,適應症包括踝部及腕部脛腓骨聯合韌帶固定手術、拇趾外翻修復手術及跗蹠關節固定手術,具革命性創新技術,提供患者在骨科四肢創傷癒合期間,自體組織穩定且持續的內固定支撐外,又保有創傷關節癒合後肢體所需自然彎曲與活動彈性。
資料來源:經濟日報 記者高行/台北報導